新一代皮膚修復模組:從 PDRN x Exosome 到 Peptides x Epi-On® x Azeclair® P 的精準再生與穩態策略
作者 | Corum Inc.
當肌膚修復科技邁入「智慧再生」時代,重點已不再是單一成分的刺激,而是以精準訊號調控與穩態微環境重建為核心。

近年來,PDRN(Polydeoxyribonucleotide) 已廣泛應用於皮膚修復與再生領域,並成為醫美療程與護膚產品中的熱門成分。它主要透過代謝後釋放腺苷(Adenosine),活化 A2A 受體,間接調節抗炎與組織修復反應,為肌膚再生奠定有效基礎。
然而,隨著對表觀遺傳調控與肌膚自癒機制的理解深化,這種以代謝產物驅動的間接活性模式,逐漸顯現出侷限性:
- 起效緩慢,需經體內酵素逐步分解 PDRN → 釋放腺苷 → 活化受體 → 啟動修復訊號;
- 易受個體代謝效率影響,導致反應差異大、活性時間難以掌控;
- 同時,PDRN 為高分子 DNA 片段(分子量約 5–150 萬 Da),因體積與極性較大,無法經皮穿透,多需透過注射或導入等方式給予。
如今,我們迎來了從「代謝效應」邁向「分子直擊」的主效分子世代 ——
以 Epi-On® 為代表的新型小分子,具備更即時、可控、且與細胞訊號高度對接的再生潛力。其分子量僅約 272 Da,符合經皮吸收理想條件(< 500 Da),能直接穿越角質層,以塗抹方式精準釋放、快速啟動修復路徑,開啟非侵入式、日常可用的「智慧修復 × 表觀調控」新策略。
Epi-On®:從組蛋白修飾出發,精準直擊細胞修復開關
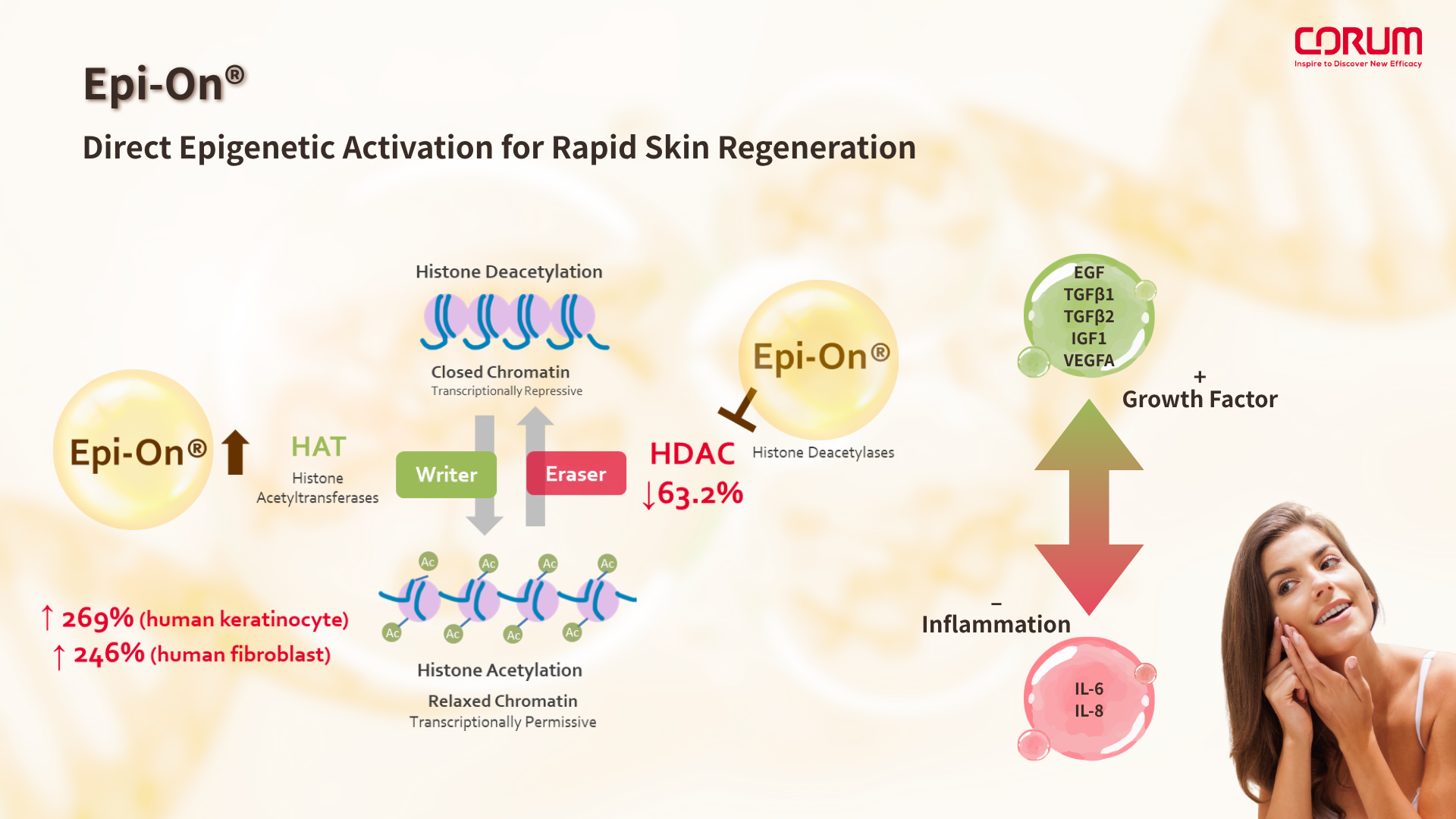
Epi-On® 作為新一代表觀遺傳調節活性分子,能夠直接促進組蛋白乙酰化修飾(Histone Acetylation),這項作用關鍵地參與細胞的抗炎、再生與遷移反應。這種機制與PDRN在體內最終代謝產生的Adenosine有相似功能,但Epi-On作為主效成分,無需仰賴體內酵素轉換,可直接作用於表觀修復與抗炎雙軌,因此:
- 更快速啟動細胞修復程序
- 更穩定地激發肌膚自癒力
- 避免代謝差異導致效果變異
Epi-On®可視為對 PDRN 作用機制的「上游主控再設計」,其直接的組蛋白修飾調控效應,不僅提升了修復效率,也大幅降低配方設計中的變數與不確定性。
Exosome 熱潮下的冷思考:miRNA Profile ≠ 全面有益
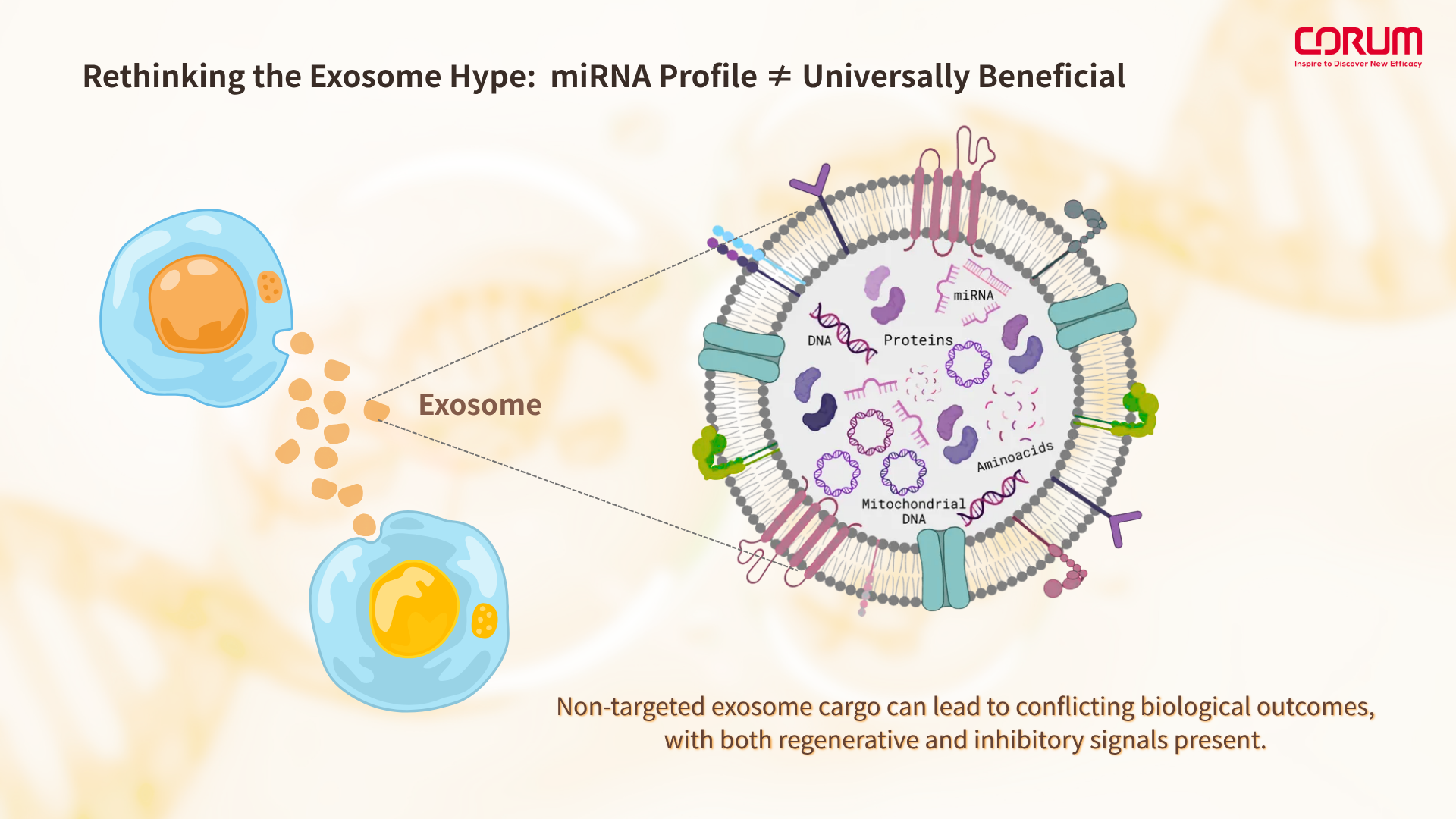
Exosome(外泌體)在近年被視為皮膚修復的「新黃金載體」,原因在於其天然來源、穿透能力佳,且攜帶多種訊號分子,包括:
- miRNA / mRNA
- Peptides胜肽
- 蛋白質 (生長因子、游離氨基酸、細胞激素等)
- 脂質與其他
然而,這樣的「多重訊號包裹」也意味著成分的不確定性。特別是其中的miRNA profile,在未經篩選或定向設計下,可能出現與修復目標相衝突的訊號干擾。
舉例而言,某些miRNA會反向干擾肌膚修復與再生機制,這將直接削弱配方中修復成分的功效。
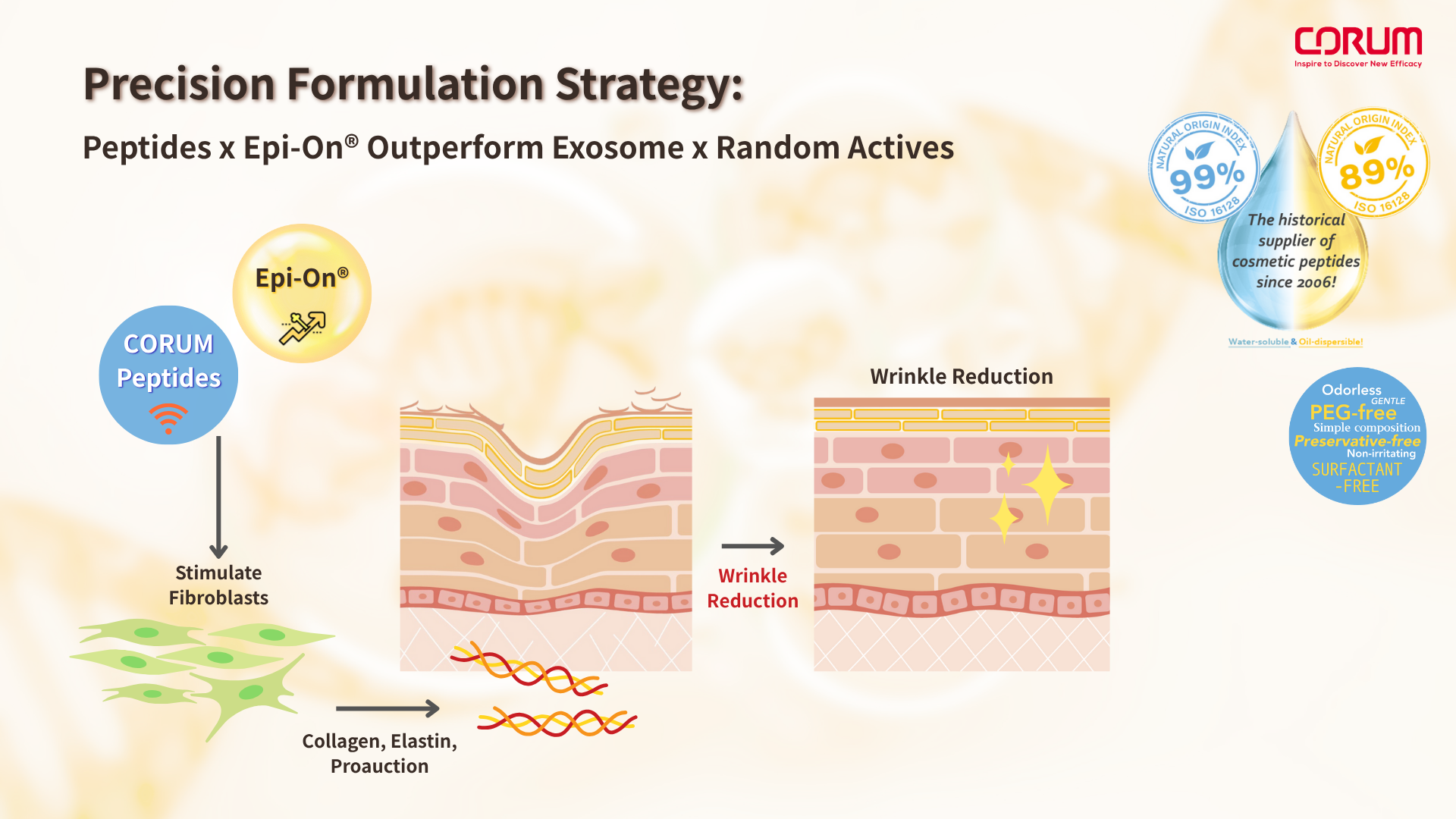
精準組合策略:Peptides x Epi-On® 優於 Exosome x任意活性
傳統的 Exosome 模型,雖然能提供初步的修復刺激,但若其內載物無法精準對應目標肌膚狀態,反而可能成為不穩定因子。此外,Exosome需與細胞狀態配合才有效,需活細胞吞噬,才得以將載體中包覆的訊號及成分帶入細胞內。若細胞活性低(如嚴重老化),反而效果打折。
相比之下,以精準修復為導向的 訊號分子Peptides + 表觀遺傳調控分子(如 Epi-On®),可根據修復所需的機制(如細胞遷移、抗發炎、重建基質)進行明確配方設計,達到以下優勢:
- 高選擇性訊號導入
- 可控濃度與穩定性
- 不受來源細胞狀態波動干擾
- 可避免miRNA與表觀基因修飾調控的相互干擾
在臨床應用上,這樣的組合更適合用於術後修復、敏弱肌膚管理、慢性發炎膚況調理等高精度需求場景。
從修復邁向穩態平衡: Azeclair® P是關鍵,讓再生更有序,讓修護更持久
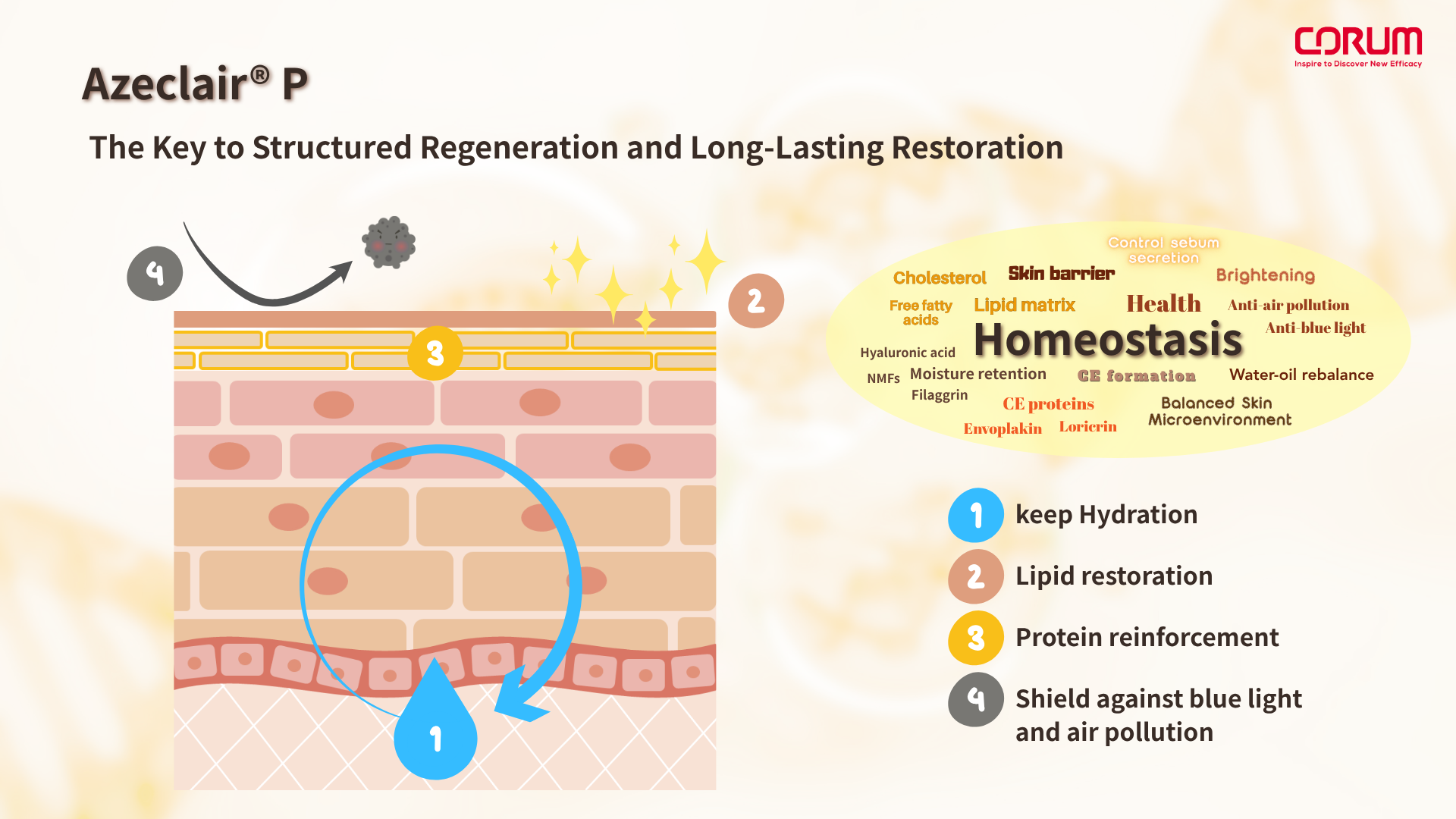
Potassium Azeloyl Diglycinate (Azeclair® P)作為新一代皮膚修復模組的穩態核心,發揮多重關鍵作用。除了廣為人知的控油與亮白效果外,我們的研究還發現,Azeclair® P 能促進玻尿酸前體(GAGs)的合成與天然保濕因子前驅蛋白 Filaggrin 的表現,有助於強化角質層內的水分循環與保濕功能。
在脂質層面,Azeclair® P 可調節皮脂分泌,同時促進細胞間脂質(intercellular lipids)的補充與排列,進一步修復受損的脂質雙層結構,改善皮膚屏障的鎖水能力與完整性。
角質蛋白方面,Azeclair® P 能提升角質形成蛋白(cornified envelope)中關鍵結構蛋白,如 envoplakin 與 loricrin 的表現,這些蛋白是維持角質層穩定排列與物理防禦能力的核心要素。
這一套從「補水、鎖水到角蛋白強化」的協同機制,使 Azeclair® P 成為支持肌膚微環境穩態的重要因子,在智慧再生修復中扮演關鍵角色。
結語:從生物模仿到精準再生,肌膚修復進入智慧時代

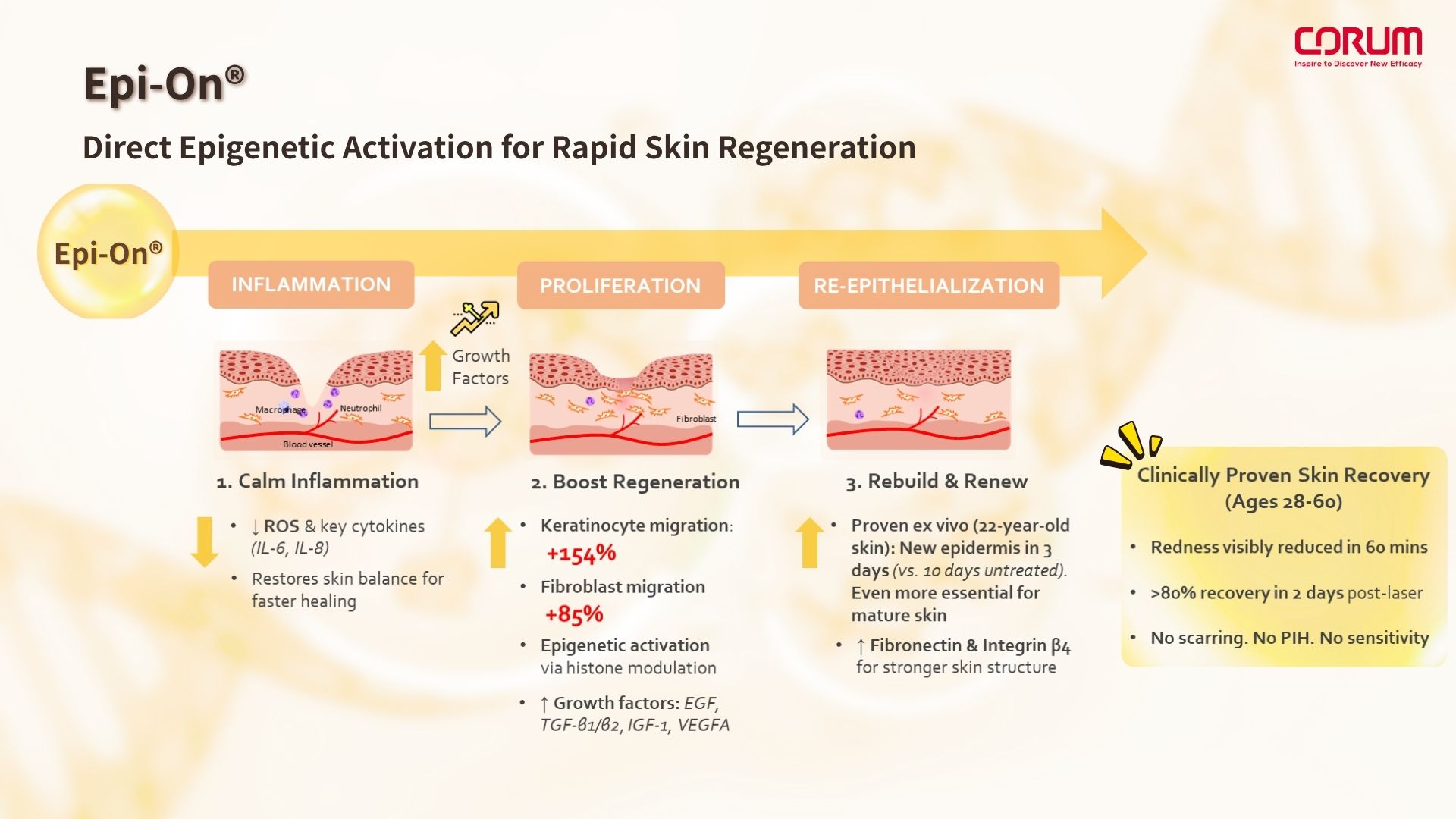
在傳統的肌膚修復策略中,PDRN和Sodium DNA曾是關鍵的啟動因子,透過核酸代謝產生腺苷,活化A2A受體,進而啟動cAMP/PKA訊號傳導路徑。PKA 不僅能直接磷酸化組蛋白(如 H3S10),促進染色質鬆開,也可活化轉錄因子 CREB,進一步招募具有 HAT(histone acetyltransferase)活性的共激活因子 CBP/p300,引發組蛋白乙醯化,協同促進修復與再生相關基因的表達。儘管 PDRN 並非典型的表觀遺傳調控劑,其間接作用路徑能為細胞提供有利的轉錄環境,成為後續再生反應的重要前導,為後續再生提供有利的初始修復環境。
Exosome 則是細胞間的「訊息郵差」,能攜帶 miRNA 等關鍵分子啟動修復。雖然 miRNA 早在 1993 年被發現,但因 2024 年獲得諾貝爾醫學生理獎而再度受到重視。隨著 exosome 萃取純化技術進步 (如超高速離心、奈米過濾、切向流過濾),商業化量產變得可行,其攜帶 miRNA 的功能也被導入醫美保養,成為近年熱門的修復輔助因子,帶動exosome、RNA-based保養品話題。
PDRN 與 Exosome 的熱潮,為我們揭示了肌膚具有強大的自癒潛能,但要進一步提升修復效率與可控性、穩定性,仍需跳脫「代謝中介」與「混合訊號」的框架。Epi-On® 的出現,象徵我們已邁入表觀遺傳與精準蛋白訊號主導的再生時代。
真正能精準傳遞再生訊號、引導結構重建的,進入的是下一階段:Peptides × Epi-On® 的組合
訊號肽分子(signaling peptides)模擬天然細胞激素或細胞訊號蛋白中的關鍵活性序列,能與細胞膜上的特定受體或訊號傳導通路結合,直接向纖維母細胞傳遞「生成膠原蛋白與彈力蛋白」的生物指令,啟動真皮層的重建與更新,是直接參與結構重塑的核心分子。
同時,Epi-On® 透過表觀遺傳機制,調控與癒合、增殖與再生相關基因的表達,讓細胞精準啟動修復,從表皮到真皮的結構重整、屏障功能恢復,達到真正的「結構性修復 × 生物性更新」。未來的肌膚修復模組,不再只依賴自然導向的生物模仿,而是藉由高精度分子設計與訊號調控,打造更穩、更快、更準的再生策略。
此外,Potassium Azeloyl Diglycinate(Azeclair® P) 的角色也不容忽視,新鈺生技深入研究後發現它是整個系統穩態的守門人。Azeclair® P 可促進 GAGs 合成與 Filaggrin 表現,強化角質與真皮間的水合作用循環(Circular Hydration),更能調控皮脂分泌、抑制發炎介質(IL-6, IL-8)、促進角化蛋白合成,並修復受損角質間脂質與外界屏障,維持肌膚微環境的平衡,是讓「再生」與「穩態」共存的關鍵因子。
未來的肌膚修復,將是訊號主導 × 微環境優化的雙核心策略
從核苷酸到肽鏈,從混合訊號傳遞到精準表觀調控,肌膚科技已從「代謝被動修復」進化為「精準調控再生」。這不再是單一活性成分的堆疊,而是一種高精度、系統性、以訊號調控與微環境重建為本的智慧再生策略。未來的肌膚修復模組,將不再只是被動修復,而是由修復走向「再生+穩態」的策略,全面喚醒肌膚的自我更新能力,實現真正的長效穩定與生物性年輕。
這也正是新鈺生技所堅持的研發使命──Deliver Only What the Skin Truly Needs。
我們專注於肌膚真正所需的訊號與環境重建分子,包括研發生產多種短鏈訊號肽(di-, tri-, tetra-, penta-, hexapeptides)、擁有創新專利的 Epi-On® 表觀遺傳調控分子,以及獨家揭示循環補水機制的 Azeclair® P,涵蓋補水、脂質修復與角化蛋白合成三重維度,為肌膚打造長效穩態的再生環境。
在肌膚科技進入精準與智慧的再生時代,新鈺生技以「真實所需、有效所用」為核心,持續以科學為本,作為肌膚醫學與保養革新的技術領航者。
小提醒給配方師:
- 使用 Exosome 時,請務必掌握其 miRNA Profile。
- 根據產品訴求選擇適當來源細胞與培養條件。
- 若主打表觀遺傳修復成分,需避免選用可能抑制組蛋白修飾的訊號成分。
- 在高敏與醫美術後產品中,Peptides + Epi-On® 模組將提供更高穩定性與安全性。
參考文獻 :
- Alsarraj J. (2006). Role of basic region leucine zipper transcription factors in controlling gene transcription in mammalian cells. ResearchGate. https://www.researchgate.net/publication/266045340_Role_of_basic_region_leucine_zipper_transcription_factors_in_controlling_gene_transcription_in_mammalian_cells
- Bertran-Gonzalez, J., Håkansson, K., Borgkvist, A., Irinopoulou, T., Brami-Cherrier, K., Usiello, A., Greengard, P., Hervé, D., Girault, J. A., Valjent, E., & Fisone, G. (2009). Histone H3 phosphorylation is under the opposite tonic control of dopamine D2 and adenosine A2A receptors in striatopallidal neurons. Neuropsychopharmacology : official publication of the American College of Neuropsychopharmacology, 34(7), 1710–1720. https://doi.org/10.1038/npp.2008.228
- Chu, C. S., Hsu, P. H., Lo, P. W., Scheer, E., Tora, L., Tsai, H. J., Tsai, M. D., & Juan, L. J. (2011). Protein kinase A-mediated serine 35 phosphorylation dissociates histone H1.4 from mitotic chromosome. The Journal of biological chemistry, 286(41), 35843–35851. https://doi.org/10.1074/jbc.M111.228064
- Galeano, M., Bitto, A., Altavilla, D., Minutoli, L., Polito, F., Calò, M., Lo Cascio, P., Stagno d'Alcontres, F., & Squadrito, F. (2008). Polydeoxyribonucleotide stimulates angiogenesis and wound healing in the genetically diabetic mouse. Wound repair and regeneration : official publication of the Wound Healing Society [and] the European Tissue Repair Society, 16(2), 208–217. https://doi.org/10.1111/j.1524-475X.2008.00361.x
- Ha, C. H., Kim, J. Y., Zhao, J., Wang, W., Jhun, B. S., Wong, C., & Jin, Z. G. (2010). PKA phosphorylates histone deacetylase 5 and prevents its nuclear export, leading to the inhibition of gene transcription and cardiomyocyte hypertrophy. Proceedings of the National Academy of Sciences of the United States of America, 107(35), 15467–15472. https://doi.org/10.1073/pnas.1000462107
- Kwok, R. P., Lundblad, J. R., Chrivia, J. C., Richards, J. P., Bächinger, H. P., Brennan, R. G., Roberts, S. G., Green, M. R., & Goodman, R. H. (1994). Nuclear protein CBP is a coactivator for the transcription factor CREB. Nature, 370(6486), 223–226. https://doi.org/10.1038/370223a0
- Lee Y., Song M., Park J., Shin M., Kim M., Hwang D., Lee D., Chung J. (2022). Histone deacetylase 4 reverses cellular senescence via DDIT4 in dermal fibroblasts. Aging, 14(11):4653–4672. https://doi.org/10.18632/aging.204118
- McKinsey, T. A., Zhang, C. L., & Olson, E. N. (2000). Activation of the myocyte enhancer factor-2 transcription factor by calcium/calmodulin-dependent protein kinase-stimulated binding of 14-3-3 to histone deacetylase 5. Proceedings of the National Academy of Sciences of the United States of America, 97(26), 14400–14405. https://doi.org/10.1073/pnas.260501497
- Ogryzko, V. V., Schiltz, R. L., Russanova, V., Howard, B. H., & Nakatani, Y. (1996). The transcriptional coactivators p300 and CBP are histone acetyltransferases. Cell, 87(5), 953–959. https://doi.org/10.1016/s0092-8674(00)82001-2
- Park S, Baek S, Shin H-J, Kim J-S, Gwon H-I, Bae S, An S. Polydeoxyribonucleotides as Emerging Therapeutics for Skin Diseases: Clinical Applications, Pharmacological Effects, Molecular Mechanisms, and Potential Modes of Action. Applied Sciences. 2025; 15(19):10437. https://doi.org/10.3390/app151910437
- Perez-Aso, M., Mediero, A., & Cronstein, B. N. (2013). Adenosine A2A receptor (A2AR) is a fine-tune regulator of the collagen1:collagen3 balance. Purinergic signalling, 9(4), 573–583. https://doi.org/10.1007/s11302-013-9368-1
- Squadrito, F., Bitto, A., Irrera, N., Pizzino, G., Pallio, G., Minutoli, L., & Altavilla, D. (2017). Pharmacological Activity and Clinical Use of PDRN. Frontiers in pharmacology, 8, 224. https://doi.org/10.3389/fphar.2017.00224
- Yang, L. L., Liu, J. Q., Bai, X. Z., Fan, L., Han, F., Jia, W. B., Su, L. L., Shi, J. H., Tang, C. W., & Hu, D. H. (2014). Acute downregulation of miR-155 at wound sites leads to a reduced fibrosis through attenuating inflammatory response. Biochemical and biophysical research communications, 453(1), 153–159. https://doi.org/10.1016/j.bbrc.2014.09.077
- Zeng, H., Guo, S., Ren, X., Wu, Z., Liu, S., & Yao, X. (2023). Current Strategies for Exosome Cargo Loading and Targeting Delivery. Cells, 12(10), 1416. https://doi.org/10.3390/cells12101416
- Zhang, W., Hsu, P., Zhong, B., Guo, S., Zhang, C., Wang, Y., Luo, C., Zhan, Y., & Zhang, C. (2018). MiR-34a Enhances Chondrocyte Apoptosis, Senescence and Facilitates Development of Osteoarthritis by Targeting DLL1 and Regulating PI3K/AKT Pathway. Cellular physiology and biochemistry : international journal of experimental cellular physiology, biochemistry, and pharmacology, 48(3), 1304–1316. https://doi.org/10.1159/000492090
- Zhao, Y., Li, S., Chen, Y., Wang, Y., Wei, Y., Zhou, T., Zhang, Y., Yang, Y., Chen, L., Liu, Y., Hu, C., Zhou, B., & Ding, Q. (2023). Histone phosphorylation integrates the hepatic glucagon-PKA-CREB gluconeogenesis program in response to fasting. Molecular cell, 83(7), 1093–1108.e8. https://doi.org/10.1016/j.molcel.2023.02.007
- Zhu, Y., Li, Z., Wang, Y., Li, L., Wang, D., Zhang, W., Liu, L., Jiang, H., Yang, J., & Cheng, J. (2016). Overexpression of miR-29b reduces collagen biosynthesis by inhibiting heat shock protein 47 during skin wound healing. Translational research : the journal of laboratory and clinical medicine, 178, 38–53.e6. https://doi.org/10.1016/j.trsl.2016.07.001







